 Лаборатория
Лаборатория|
|
Назад к списку
19 июля 2013
НОВЫЕ ЛАБОРАТОРНЫЕ ТЕХНОЛОГИИ ДЛЯ ОПРЕДЕЛЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВОпределение скорости оседания эритроцитов (СОЭ) является со ставной частью общего анализа крови. Впервые для практической медицины использование СОЭ было предложено шведским врачом R. Fahraeus в 1921 году [6]. Сущность анализа состоит в том, что если взять пробу крови в пробирку с антикоагулянтом (чтобы кровь не свернулась) и оставить ее в покое, то эритроциты начинают медленно падать (оседать) на дно пробирки, оставляя над собой слой жидкой плазмы. На этом феномене основано определение СОЭ. Однако широко в клинической практике определение СОЭ стало использоваться лишь после того, как Альф Вестергрен (A. Westergren, шведский врач, родился в 1891 г.), предложил удобный способ измерения скорости оседания эритроцитов в цельной крови в вертикально установленной стеклянной трубке [12].
В лаборатории стеклянную капиллярную трубку стандартной длины заполняют кровью с антикоагулянтом и оставляют ее в вертикальном положении на определенное время (обычно на 1 ч). В течение этого времени эритроциты оседают, оставляя над собой столбик прозрачной плазмы. Через 1 ч измеряют расстояние между верхней границей плазмы и осевшими эритроцитами. Это расстояние, пройденное оседающими эритроцитами за 1 ч, и является скоростью оседания эритроцитов. Ее величину выражают в миллиметрах в час.
В самом процессе оседания эритроцитов выделяют 3 фазы:
1. агрегация – первичное формирование столбиков эритроцитов;
2. седиментация – быстрое появление эритро-плазматической границы – продолжение формирования столбиков эритроцитов и их оседание;
3. уплотнение – завершение агрегации эритроцитов и оседания столбиков эритроцитов на дне пробирки.
Графически процесс СОЭ описывается S-образной кривой, которая представлена на рис. 1.
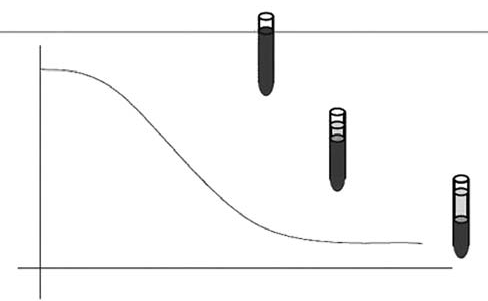 Рисунок 1. Процесс СОЭ.
МЕТОДЫ ОПРЕДЕЛЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВВ практике клинико-диагностических лабораторий (КДЛ) применяются следующие методы определения СОЭ:
1. метод Панченкова;
2. метод Вестергрена и его модификации;
3. метод измерения кинетики агрегации эритроцитов.
У нас в стране широкое распространение получил метод Панченкова [1]. В этом методе используется стандартный стеклянный капилляр длиной 172 мм, наружным диаметром 5 мм и диаметром отверстия – 1,0 мм. Он имеет четкую коричневую градуировку от 0 до 10 см, шаг шкалы – 1,0 мм, верхнее деление шкалы отмечено «0» и буквой «К» (кровь), напротив деления 50 имеется буква «Р» (реактив).
Методика определения СОЭ методом Панченкова включает следующие этапы:
1. подготовить 5% раствор натрия цитрата и внести на часовое стекло;
2. промыть капилляр 5% раствором натрия цитрата;
3. произвести забор капиллярной крови в промытый капилляр;
4. перенести кровь из капилляра на часовое стекло;
5. повторить шаги 3 и 4;
6. перемешать кровь с натрия цитратом на часовом стекле и вновь заполнить капилляр;
7. установить капил ляр в штатив Панченкова и включить таймер для каждого капилляра отдельно;
8. через 1 ч определить СОЭ по высоте столба прозрачной плазмы.
Метод Панченкова имеет ряд принципиальных недостатков обусловленных плохой стандартизацией производимых промышленностью капилляров, необходимостью использовать для анализа только капиллярную кровь, а также невозможностью адекватно отмыть капилляр при многократном применении. В последние годы метод Панченкова стал применяться для определения СОЭ венозной крови, не смотря на то, что никаких научно-практических исследований по референтным величинам для этого метода, по изучению влияния различных факторов при исследовании венозной крови проведено не было. Поэтому метод Панченкова в настоящее время является источником ошибочных результатов и проблем в работе КДЛ и деятельности врачей-клиницистов, не используется в других странах (кроме стран бывшего СССР) и должен быть исключен из практики лабораторий.
Наиболее широкое распространение в развитых странах мира для определения СОЭ получил метод Вестергрена, который с 1977 года рекомендован Международным Советом по Стандартизации в Гематологии для применения в клинической практике [9]. В классическом методе Вестергрена используют стандартные капилляры из стекла или пластика длиной 300 мм ± 1,5 мм (рабочей является длина капилляра 200 мм), диаметром – 2,55 мм ± 0,15 мм, что повышает чувствительность метода. Время измерения – 1 ч. Для анализа может быть использована как венозная, так и капиллярная кровь. Методика определения СОЭ методом Вестергрена включает следующие этапы:
1. венозная кровь берется в вакуумные пробирки с К-ЭДТА (капиллярная кровь берется в пробирки с К-ЭДТА);
2. пробу венозной (капиллярной) крови смешать с 5% раствором натрия цитрата в соотношении 4:1;
3. произвести забор крови в капилляр Вестергрена;
4. через 1 ч измерить СОЭ по высоте столба прозрачной плазмы.
Метод Вестергрена в настоящее 41 время полностью автоматизирован, что существенно повышает производительность КДЛ и качество результатов. Вместе с тем, необходимо понимать, что классический метод Вестергрена имеет целый ряд модификаций, сущность которых состоит в уменьшении длины капилляра (например, используются моноветты или вакуумные пробирки с раствором натрия цитрата рабочая длина которых составляет 120 мм, а не 200 мм, как в классическом методе Вестергрена), изменении угла установки капилляра (например, ряд фирм использует установку вакуумных пробирок под углом 18°), укорочении времени для наблюдения за оседанием эритроцитов (до 30–18 мин) или сочетании этих изменений. Насколько такие модификации можно называть методом Вестергрена в научной литературе не решен.
На результаты определения СОЭ методом Панченкова и классическим методом Вестергрена могут оказывать существенное влияние ряд факторов преаналитического и аналитического этапов (не связанных с заболеванием пациента) производства лабораторных анализов:
• температура в помещении где проводится анализ (повышение температуры в помещении на 1 °С увеличивает СОЭ на 3%);
• время хранения пробы (не более 4 ч при комнатной температуре);
• используемый антикоагулянт (рекомендован цитрат натрия);
• правильная вертикальность установки капилляра;
• длина капилляра;
• внутренний диаметр капилляра;
• степень разведения крови антикоагулянтом (рекомендуемое разведение 4:1);
• величина гематокрита.
Низкие значения гематокрита (?35%) могут вносить искажения в результаты определения СОЭ. Для получения правильного результата необходим пересчет по формуле Фабри (T.L. Fabry) [5]:
(СОЭ по Вестергрену · 15)/ (55 – гематокрит).
Кроме того, для получения адекватных результатов СОЭ этих методов важно правильно учитывать временные затраты, которые возникают при их практическом выполнении в лаборатории. Так, общее количество времени, затрачиваемое на постановку одной пробы СОЭ, составляет 25–30 с. Если в КДЛ лаборант одновременно ставит 10 проб СОЭ, то временные затраты от первой пробы до последней составят 250–300 с (4 мин 10 с – 5 мин).
Если не учитывать эти временные затраты, то можно получить неправильные результаты исследования, так как СОЭ между 60 и 66 мин (время «остановки» СОЭ) может измениться на 10 мм. Большим недостатком метода Вестергрена является отсутствие возможности осуществлять внутрилабораторный контроль качества.
Данные многих публикаций свидетельствуют о том, что такой контроль в отношении метода Вестергрена является объективной необходимостью. Результаты исследования параллельно тестируемых проб, проведенные Национальной академией клинической биохимии и стандартизации США показали достаточно высокую аналитическую вариацию для определения СОЭ методом Вестергрена – 18,99% [9].
Учитывая все эти недостатки метода Вестергрена, компанией Alifax в 90-е годы был разработан и предложен для использования в клинической практике для определения СОЭ – метод измерения кинетики агрегации эритроцитов. Метод по своей технологии коренным образом отличается от метода Вестергрена, так как определяет агрегационную способность эритроцитов с помощью измерения оптической плотности [10]. Теоретическим основанием данного метода определения СОЭ для его использования в клинической практике служит агрегационная модель оседания эритроцитов, объясняющая этот процесс образованием агрегатов эритроцитов при адсорбции на них макромолекул, способствующих их адгезии, и оседанием агрегатов в соответствии с законом Стокса.
Согласно данному закону, частица, плотность которой превышает плотность среды, оседает под действием силы тяжести с постоянной скоростью. Cкорость оседания пропорциональна квадрату радиуса частицы, разнице ее плотности и плотности среды, и обратно пропорциональна вязкости среды [3]. Сущность новой технологии определения СОЭ, разработанной компанией Alifax, представлена на рис. 2.
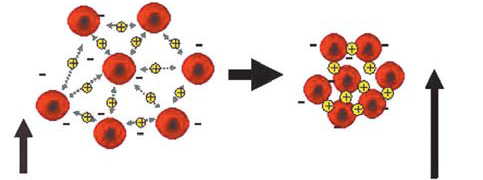 Рисунок 2. Измерение кинетики агрегации эритроцитов.
Каждая проба крови измеряется 1000 раз за 20 секунд. Оптическая плотность автоматически переводится в мм/ч. Измерение агрегации эритроцитов осуществляется автоматически в микрокапилляре анализатора СОЭ, который моделирует кровеносный сосуд. При заборе крови у пациента для определения СОЭ в качестве антикоагулянта используется ЭДТА, что позволяет для анализа использовать пробу крови, взятую для исследования на гематологическом анализаторе (определения основных показателей общеклинического анализа крови).
Корреляция данной технологии с классическим методом Вестергрена составляет 94–99% [4, 8, 11]. Кроме того, при определении СОЭ с использованием ЭДТА стабильность крови увеличивается до 48 ч при температуре хранения 4 °С.
Объектом исследования для анализаторов компании Alifax может быть венозная и капиллярная кровь. Анализаторы компании Alifax поддерживают постоянную физиологическую температуру (37°C) в отсеке для загрузки проб с помощью термостата. Благодаря этому, обеспечивается стабильность результатов исследований вне зависимости от внешней температуры. Низкий уровень гематокрита (?35%) не оказывает влияние на результаты анализа. Нет необходимости использовать формулу Фабри для пересчета полученных значений с поправкой на гематокрит. Более того, анализаторы дополнительно отмечают результаты с низким гематокритом звездочкой (*) [8].
Анализаторы компании Alifax измеряют кинетику агрегации эритроцитов, благодаря этому, данная методика способна устранить влияние факторов преаналитического и аналитического этапов, присущие классическому методу Вестергрена, основанном на оседании [11].
Для калибровки анализаторов компании Alifax и проведения регулярного контроля качества используются специальные латексные частицы. Наборы латексных контролей трех уровней выпускаются готовыми к использованию – низкий (3–6 мм/ч), средний (23–33 мм/ч) и высокий (60–80 мм/ч) [4].
На основании исследования контрольных материалов строится карта Леви-Дженнингса, а результаты регулярного внутрилабораторного контроля качества оценивают согласно правилам Westgard.
ФАКТОРЫ, ОПРЕДЕЛЯЮЩИЕ СКОРОСТЬ ОСЕДАНИЯ ЭРИТРОЦИТОВСкорость, с которой оседают эритроциты, представляет собой феномен, который зависит от целого ряда факторов. Понимание роли этих факторов имеет прямое отношение к той диагностической информации, которую представляет определение СОЭ.
В первую очередь, эритроциты опускаются на дно капилляра, так как имеют большую плотность, чем плазма, в которой они взвешены (удельная плотность эритроцитов 1096 кг/м3, удельная плотность плазмы 1027 кг/м3) [3]. Во вторых, эритроциты несут на своей поверхности отрицательный заряд, который определяют белки, связанные с их мебраной. В результате у здоровых людей эритроциты падают вниз каждый сам по себе, так как отрицательный заряд способствует их взаимному отталкиванию. Если по какой-либо причине эритроциты перестают отталкиваться друг от друга, то происходит их агрегация с формированием «монетных столбиков». Образование монетных столбиков и агрегация эритроцитов, увеличивая массу оседающих частиц, ускоряет оседание. Именно этот феномен встречается при многих патологических процессах, сопровождающихся ускорением СОЭ.
Основным фактором, влияющим на образование монетных столбиков из эритроцитов, является белковый состав плазмы крови. Все белковые молекулы снижают отрицательный заряд эритроцитов, способствующий поддержанию их во взвешенном состоянии, но наибольшее влияние оказывают асимметричные молекулы – фибриноген, иммуноглобулины, а также гаптоглобин. Повышение концентрации в плазме крови этих белков, способствует повышению агрегации эритроцитов. Очевидно, что и заболевания, связанные с увеличением уровня фибриногена, иммуноглобулинов и гаптоглобина, будут сопровождаться ускорением СОЭ. На отрицательный заряд эритроцитов влияют и другие факторы: рН плазмы (ацидоз снижает СОЭ, алкалоз повышает), ионный заряд плазмы, липиды, вязкость крови, наличие антиэритроцитарных антител.
Число, форма и размер эритроцитов также влияют на величину СОЭ. Эритропения ускоряет оседание, однако при выраженной серповидности, сфероцитозе, анизоцитозе скорость оседания может быть низкой (форма клеток препятствует образованию монетных столбиков). Повышение количества эритроцитов в крови (эритремия) снижает СОЭ. Референтные величины СОЭ приведены в табл. 1 [2].
Таблица 1. Референтные величины СОЭ по Вестергрену Возраст СОЭ, мм/ч.
Величины СОЭ постепенно повышаются с возрастом: примерно на 0,8 мм/ч каждые пять лет. У беременных женщин СОЭ обычно повышена, начиная с 4-го месяца беременности, к ее концу достигает пика – 40–50 мм/ч, и возвращается к норме после родов. Необходимо констатировать, что попытки адаптировать референтные величины СОЭ для метода Вестергрена и метода Панченкова нельзя считать научно-обоснованными.
Величина СОЭ не является специфическим показателем для какоголибо определенного заболевания. Однако нередко при патологии ее изменения имеют диагностическое и прогностическое значение и могут служить показателем эффективности проводимой терапии.
ПРИЧИНЫ ПОВЫШЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВНаряду с повышением температуры тела и величины пульса ускорение СОЭ встречается при многих заболеваниях. Изменение состава белков плазмы и их концентрации, которые являются основной причиной повышения СОЭ, – признак любого заболевания, связанного со значительным повреждением тканей, воспалением, инфекцией или злокачественной опухолью. Не смотря на то, что в ряде случаев СОЭ при этих состояниях может оставаться в пределах нормы, в целом, чем выше СОЭ, тем больше вероятность наличия у больного повреждения тканей, воспалительного, инфекционного или онкологического заболевания. Наряду с лейкоцитозом и соответствующими изменениями лейкоцитарной формулы, повышение СОЭ служит достоверным признаком наличия в организме инфекционных и воспалительных процессов. В остром периоде при прогрессировании инфекционного процесса происходит увеличение СОЭ, в период выздоровления СОЭ замедляется, но несколько медленнее в сравнении со скоростью уменьшения лейкоцитарной реакции.
Воспалительные заболевания.
Любой воспалительный процесс в организме сопровождается повышенным синтезом белков плазмы (белки «острой фазы»), включая фибриноген, что способствует формированию монетных столбиков из эритроцитов и ускорению СОЭ. Поэтому определение СОЭ широко использую в клинической практике для подтверждения воспаления при диагностике таких хронических заболеваний, как ревматоидный артрит, болезнь Крона, язвенный колит. Измерение СОЭ позволяет определить стадию заболевания (обострение или ремиссия), оценить его активность и эффективность лечения. Повышение СОЭ указывает на активный воспалительный процесс у больного и, следовательно, отсутствие реакции на проводимую терапию. Наоборот, снижение СОЭ свидетельствует о стихании воспаления в ответ на лечение. Нормальная СОЭ в большинстве случаев исключает наличие воспалительного процесса.
Инфекционные заболевания.
При всех инфекционных заболеваниях иммунная система реагирует повышением продукции антител (иммуноглобулинов). Повышенная концентрация иммуноглобулинов в крови – одна из причин, увеличивающих склонность эритроцитов к агрегации и образованию монетных столбиков. Поэтому все инфекционные заболевания могут сопровождаться ускорением СОЭ. При этом бактериальные инфекции чаще, чем вирусные проявляются повышением СОЭ. Особенно высокое СОЭ наблюдается при хронических инфекциях (подострый бактериальный эндокардит). Повторные исследования СОЭ позволяют оценить динамику течения инфекци-
онного процесса и эффективность лечения.
Онкологические заболевания.
Большинство больных с различными формами злокачественных опухолей имеют повышенную СОЭ. Однако повышение отмечается не у всех пациентов, поэтому измерение СОЭ не используют для диагностики онкологических заболеваний. Но в отсутствие воспалительного или инфекционного заболевания значительное повышение СОЭ (выше 75 мм/ч) должно вызвать настороженность в отношении наличия злокачественной
опухоли.
Особенно выраженное ускорение СОЭ (60–80 мм/ч) характерно для парапротеинемических гемобластозов (миеломная болезнь, болезнь Вальденстрема). Миеломная болезнь – злокачественное заболевание костного мозга с неконтролируемой пролиферацией плазматических клеток, вызывающей разрушение костей и боли в костях. Атипичные плазматические клетки синтезируют огромное количество патологических иммуноглобулинов (парапротеинов), в ущерб нормальных антител. Парапротеины усиливают образование монетных столбиков эритроцитов и повышают СОЭ.
Ускорение СОЭ наблюдается почти у всех больных при злокачественном заболевании лимфатических узлов – болезни Ходжкина. Повреждение тканей. Ряд заболеваний, при которых происходит повреждение тканей, сопровождаются ускорением СОЭ. Например, инфаркт миокарда вызывает повреждение миокарда. Последующий воспалительный ответ на это повреждение включает синтез белков «острой фазы» (в том числе фибриногена), что усиливает агрегацию эритроцитов и увеличивает СОЭ. Аналогичная ситуация возникает при остром деструктивном панкреатите.
Уровень повышения СОЭ и частота изменения этого показателя у пациентов с различными заболеваниями представлены на рис. 3 [7]
Чувствительность и специфичность СОЭ для выявления патологии при различных порогах принятия решения представлены на рис. 4 [7].
ПРИЧИНЫ СНИЖЕНИЯ СКОРОСТИ ОСЕДАНИЯ ЭРИТРОЦИТОВСнижение СОЭ встречается в клинической практике значительно реже и не имеет большого клинического значения. Наиболее часто снижение СОЭ выявляют при эритремии и реактивных эритроцитозах (вследствие увеличения количества эритроцитов), выраженной недостаточности кровообращения, серповидно-клеточной анемии (форма клеток препятствует образованию монетных столбиков), механической желтухе (предположительно связано с накоплением в крови желчных кислот).
В заключение необходимо заметить, что, несмотря на широкое применение в клинической практике, определение СОЭ имеет ограниченное диагностическое значение. Вместе с тем, большинство авторитетных экспертов в области клинической медицины, однозначно указываю на то, что диагностические возможности этого метода используются далеко не полностью, и основная проблема для практики отечественных КДЛ лежит в плоскости методических особенностей постановки теста.
СПИСОК ЛИТЕРАТУРЫ1. Панченков Т.П. Определение оседания эритроцитов при помощи микрокапилляра // Врач. дело. – 1924. – № 16–17. – С. 695–697.
2. Тиц Н. (ред.). Энциклопедия клинических лабораторных тестов: Пер. с англ. – М.: Лабинформ, 1997. – 942 с.
3. Чижевский А.Л., Биофизические механизмы реакции оседания эритроцитов. – Новосибирск: Наука, 1980. – 173 с.
4. de Jonge N., Sewkaransing I., Slinger J., Rijsdijk J.J.M. Erythrocyte Sedimentation Rate by Test-1 Analyzer // Clinical Chemistry. – 2000. – Vol. 46. – June. – P. 881–882.
5. Fabry T.L. Mechanism of erythrocyte aggregation and sedimentation // Blood. – 1987. – Vol. 70. – № 5. – P. 1572–1576.
6. Fahrаeus R. The suspension stability of blood // Physiol. Rev. – 1929. – Vol. 9. – P. 241–274.
7. Fincher R.M., Page M.I. Clinical signifi - cance of extreme elevation of erythrocyte sedimentation rate // Arch. Intern Med. – 1986. – Vol. 146. – P. 1581–1583.
8. Lee B.H., Choi J., Gee M.S., Lee K.K., Park H. Basic Evaluation and Reference Range Assessment of TEST1 for the Automated Erythrocyte Sedimentatioon Rate // Journal of Clinical Pathology and Quality Control. – 2002. – Vol. 24. – № 1. – P. 621–626.
9. NCCLS «Reference and Selected Procedure or ESR Test; Approved standard – 4th Edition». – Vol. 20. – № 27. – P. 10.
10. Plebani M., De Toni S., Sanzari M.C., Bernardi D., Stockreiter E. The TEST 1 Automated System – a new method for measuring the erythrocyte sedimentation rate // Am. J. Clin. Pathol. – 1998. – Vol.
110. – P. 334–340.
11. Reis J., Diamantino J., Cunha N., Valido F. Erythrocyte sedimentation rate in blood a comparison of the Test 1 ESR system with the ICSH reference method // Clinical Chemistry and Laboratory Medicine. – 2007. – Vol. 45 Special Supplement. – P. S118. – MO77.
12. Westergren A. Studies on the suspension stability of the blood in pulmonary tuberculosis // Acta Med. Scand. – 1921. – Vol. 54. – P. 247–281.
Задать вопрос о технологии |

