На современном этапе развития биохимии и молекулярно-структурного анализа биологических объектов реальностью стал научно-исследовательский подход, который можно было бы обозначить как «универсомный» и суть которого - детекция всего спектра веществ определенного типа (либо значительной его части) в изучаемом образце.
Самым старым понятием, с которого данная методология начала свое развитие, является «геном» - система абсолютно всех генов живого существа, заключенных в нуклеоиде или хромосомах клеточного ядра. История этого термина восходит ко времени зарождения фундаментальной генетики. Долгое время он служил абстракцией, которую использовали, в том числе и для того, чтобы подчеркнуть ограниченность общего числа генов любого организма.
Следствием расшифровки генома человека, что случилось в начале XXI века, стала эволюция таких понятий, как «липидом» (все жировые, фосфолипидные, гликолипидные молекулы и комплексы клетки, ткани, организмов в аспектах количества и взаимосвязей); «транскриптом» (все сигнальные нуклеиновые кислоты, а также задействованные в транскрипции и трансляции внутриклеточные структуры и межклеточные механизмы); «метаболом» (все промежуточные и окончательные продукты синтеза, расщепления, переработки в клетках и тканях). «Протеом» - система всех белков и полипептидов изучаемого образца (от клетки до всего организма), а «протеомика» - наука, изучающая весь набор белков тела человека (порядка 300 000).
Первые клинические тесты на выявление в моче белка Bence-Jones относятся к 1847 году. В течение 20-го столетия получили свое развитие такие технологии определения протеинов в биологических жидкостях, как хроматография, серологические и иммунологические приложения, электрофорез (в том числе и двумерный). Однако, по большей части, исследования белков проводились по принципу «один тест - один протеин». Термин «протеомика» стал широко употребляться в 1994 году, к тому времени уже существовали первые прототипы времяпролетных масс-спектрометров.
Проблему множества пептидов в биологических жидкостях, превосходящего способности современных анализаторов сепарировать все эти вещества, на сегодняшний день решают несколькими способами. Существуют различные модификации многомерной хроматографии и других техник множественного фракционирования, интегрированные с последними достижениями в области масс-спектрометрии. Несколько обособленно позиционируется т.н. «структурная» протеомика (которую чаще называют «структурной геномикой») как складывающаяся в международный проект система научно-исследовательских усилий по определению пространственного строения крупных глобулярных белковых молекул методами рентгеноструктурного анализа и спектроскопии ядерно-магнитного резонанса.
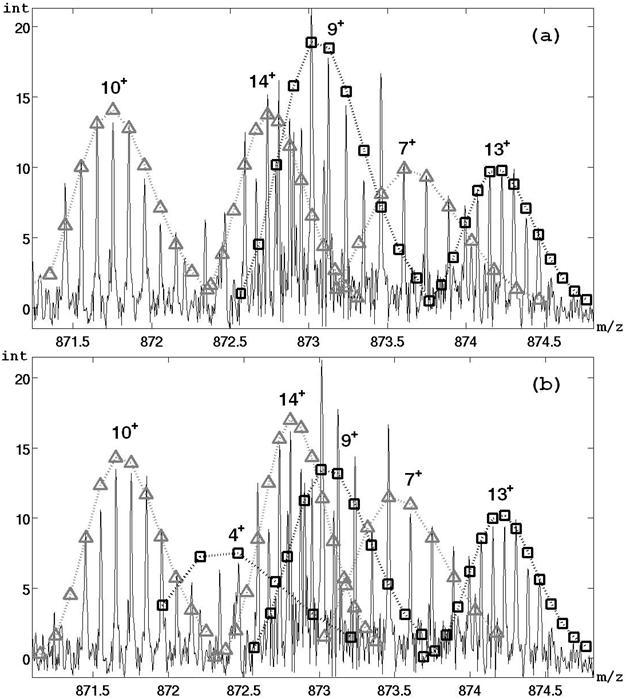
Масс-спектрометрия образца плазмы, методика диссоциации электронного захвата при исследовании белков группы карбоангидразы. Источник: Barbarini N., Magni P. Accurate peak list extraction from proteomic massspectra for identification and profiling studies. BMC, Bioinformatics 2010, 11: 518.
Арсенал методов современной аналитической протеомики можно подразделить на две большие группы - top-down («нисходящие») и bottom-up («восходящие»). Первый из этих классов имеет целью выделение интактных пептидов и их изолированный анализ. Наиболее совершенные из «нисходящих» техник - MALDI-TOF-MS (matrix-assisted laser desorption/ ionization time-of-flight mass-spectrometry, времяпролетная масс-спектрометрия, дополненная матричной десорбцией/ ионизацией, или матрикс-ассоциированной десорбцией/ ионизацией) и SALDI-TOF-MS (SALDI, surface-enhanced laser desorption/ ionization - поверхностно-усиленная десорбция/ ионизация). Преимущества «нисходящих» парадигм - идентификация неповрежденных пептидов в их нативных вариациях, возможность детекции изоформ, способность исследовать крупные макромолекулы глобулярных белков, более полный охват их характеристик. Недостатки - огромная трудоемкость, большие временные затраты на каждый тест.
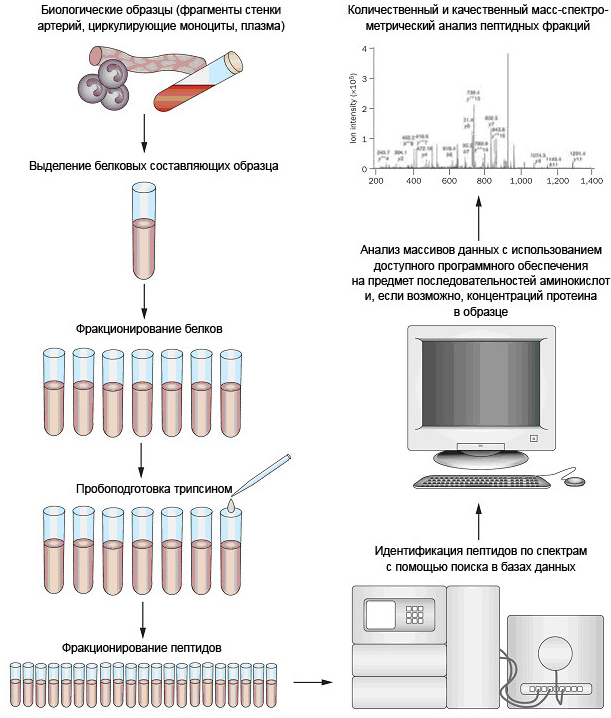
Использование масс-спектрометрии для получения и исследования новых биомаркеров. Источник: Hodges, A. et al. Nat. Immunol. 8, 2007, p. 569-577
Как восходящие, так и нисходящие методы протеомного и метаболомного анализа в руках современных ученых нацелены на проработку двух вариантов совершенствования скрининга, диагностики и мониторинга различных заболеваний. Первый представляет собой идеальную схему решения проблемы через открытие т.н. «биомаркеров» - таких веществ, которые появляются в тканях и биологических жидкостях организма только при строго определенных патологических процессах, легко детектируются современными биохимическими приложениями и с максимально высокой долей вероятности свидетельствуют о конкретном заболевании при обнаружении у конкретного пациента. Детекция такого биомаркера во взятых для анализа биологических образцах может лечь в основу диагностического теста, обладающего самым прогрессивным сочетанием операционных характеристик - чувствительности, специфичности, точности, воспроизводимости результатов и др.
Однако в реальности «отработать» идеальный биомаркер для каждой нозологической единицы пока не удается. Чаще исследователи говорят о «протеомных профайлах» - целых спектрах довольно специфичных белков и пептидов, которые характерны для тех или иных патологических состояний с минимальной индивидуально-типологической разницей. Специфичность профайла для конкретного заболевания (их группы) оценивают на основании патологических изменений содержания в образце протеинов в определенных диапазонах масс, преобладания либо недостаточности полипептидов определенных групп, множественности аномальных изоформ/ трансформаций сходного образа для разных белков. Например, по данным Cazares LH et al. (2002), протеомные профайлы лизатов, полученных из удаленных при операциях тканей ДГПЖ, сильно отличаются от профайлов рака предстательной железы на разных стадиях. Для доброкачественного процесса характерны пиковые концентрации белков в районе 5666 Da., в то время как протеомный спектр раковых тканевых массивов представлен преобладанием низкомолекулярных соединений в диапазоне 3000 - 5000 Da.
Примеры использования протеомно-метаболомного анализа в медицинских исследованиях
Pang J et al. (2010) установили, что метастазирование рака предстательной железы сопряжено с изменениями тканевой экспрессии не менее 58 белков, 6 из которых (e-FABP-5, MCCC-2, PPA-2, эзрин, SM-22 и SLP-2) функционально релевантны метастазам в лимфатические узлы и могут рассматриваться на роль биомаркеров этого процесса. Более того, лимфогенное метастазирование сопровождается повышением сывороточных титров соединения e-FABP-5, что так же можно использовать в диагностических целях.
Kistler AD et al. (2009) исследовали протеомные профайлы, которые специфичны для поликистоза почек, наследуемого по аутосомно-доминантному типу. Релевантными оказались 197 белков, в большинстве своем фрагменты молекул коллагенов и уромодулинов. 38 пептидов отличились высокой чувствительностью и специфичностью при сравнении с группами здоровых субъектов, пациентов с другими урологическими заболеваниями и раком почек/ мочевого пузыря.
Открытие новой нозологической единицы. Склероз простаты, ретроперито-неальный фиброз в некоторых случаях могут быть маской т.н. «аутоиммунного панкреатита» или IgG4-синдрома, при котором диссеминированные поражения различных органов и систем организма происходят попутно с хроническим воспалением поджелудочной железы, дефектами гепато-биллиарного дерева на фоне стойкой гипергамма-глобулинэмии и повышенных титров аутоантител к АСА-II (по Sánchez-Castañón M et al., 2010).
Использование протеомно-метаболомного анализа для исследования сердечно-сосудистых заболеваний
Urbonavicius S, Lindholt JS, Delbosc S, Urbonaviciene G et al. Proteins associated with the size and expansion rate of the abdominal aortic aneurysm wall as identified by proteomic analysis. Interact Cardiovasc Thorac Surg. 2010 Oct; 11 (4): 433-41.
Группа ученых из Дании исследовала белковые фракции образцов стенки аневризм брюшной аорты от 15 больных 68 - 83 лет методами двухмерного гель-электрофореза с последующей масс-спектрометрией и жидкостной хроматографией, ассистированной тандемной масс-спектрометрией. Для анализа брали участки передней стенки аневризмы по всей толщине в точке максимальной дилятации. Это делалось в момент хирургической резекции инфраренальных аневризм. 16 протеиновых спотов (электрофореграммных «пятен», ассоциированных с белковыми фракциями) сильно коррелировали со скоростью увеличения аневризматического выпячивания. 9 из них удалось идентифицировать. 6 спотов проявили сильную связь с размером аневризмы, из них 3 идентифицированных: витронектин со следами кальретикулина, альбуминовая группа и спот из двух составляющих в виде α-3(VI) ветви коллагена и витамин-D-связывающего протеина. Интересно, что, согласно предыдущим исследованиям датской группы, выявлен недостаток витронектина в группе с разрывами аневризм брюшной аорты по сравнению с пациентами без разрывов аневризм.
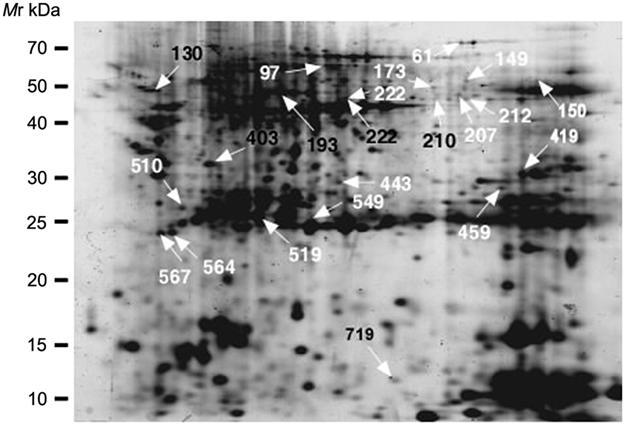
Специалисты Медицинского колледжа Висконсина (Милуоки) предприняли количественное сравнение фракций липопротеинов плазмы и сыворотки человека методом жидкостной хроматографии/ тандемной масс-спектрометрии с целью установить, какая из этих биологических жидкостей обеспечит лучшие операционные характеристики соотв. тестов. Приготовление сыворотки крови несколько более трудоемко, однако считается, что по сравнению с плазмой она обеспечивает большую стабильность благодаря отсутствию фибриногена.
Липопротеины (ЛП) - сложные глобулярные молекулы, играющие ключевую роль в транспорте и метаболизме холестерола, который имеет большое значение для развития атеросклероза и кардиоваскулярных заболеваний. Белковая составляющая липопротеиновых молекул существенна для их функции, ЛП низкой плотности (ЛПНП) состоят из пептидных последовательностей на 22%. ЛП высокой плотности (ЛПВП) состоят из пептидных последовательностей на 15%. Это оправдывает протеомный подход для исследования этих веществ.
Сопоставляли тесты по определению липопротеинов высокой и низкой плотности в плазме и сыворотке крови от одних и тех же пациентов. Оказалось, что 16 протеинов уникальны только для фракции ЛПНП в рамках парного качественного сравнения: различные субъединицы комплемента C1q, C1r и C1s, фиколин-3, цепочки фактора коагуляции XIII-А, галектин-3-связывающий протеин и др. Для фракции ЛПВП в рамках парного качественного сравнения уникальными признаны 65 белков. В целом, отмечен существенный перехлест белковых фракций ЛПНП и ЛПВП, а так же тот факт, что результаты других сходных по дизайну сопоставлений различных липопротеинов сильно различаются. Это свидетельствует не в пользу воспроизводи-мости метода. Тем не менее, анализ сывороток сопровождался большей точностью и наглядностью по сравнению с тестами плазмы. В частности, у такого специфичного для ЛПНП агента, как apoB-100 сывороточная концентрация существенно превосходила плазменную.
Fernández Parguiña A, Grigorian-Shamajian L, Agra RM, Teijeira-Fernández E et al. Proteins involved in platelet signaling are differentially regulated in acute coronary syndrome: a proteomic study. PLoS One. 2010 Oct., 14; 5 (10): e13404.
Коллектив испанских ученых сконцентрировал исследовательские усилия на изменениях регуляции тромбоцитарных сигнальных протеинов при остром коронарном синдроме. Эти форменные элементы играют принципиальную роль в локальных нарушениях свертывания крови, приводящих к тромбированию коронарных артерий, острому коронарному синдрому (ОКС) и инфаркту миокарда. К тому же, в тромбоцитах нет ядра, все сигнальные и синтетические процессы регулируются пептидами. Это делает протеомный анализ методом выбора для изучения глубоких патофизиологических моментов острого коронарного синдрома.
Проводили основанный на двумерном гель-электрофорезе масс-спектро-метрический протеомный анализ (высокое разрешение) тромбоцитарного материала от пациентов с ОКС без поднятия сегмента ST на ЭКГ. В обеих выборках больных удавалось исследовать до 2300 отдельных белковых групп. Из них 5 имели в геле по несколько спотов, а 40 - различные параметры регуляции по сравнению с контролем (10 up-регуляция, 30 - down-регуляция). Эта разница последовательно уменьшалась на 5-й день лечения ОКС и через полгода после приступа. Сконцентрировавшись на этих аномально ведущих себя протеинах, испанские ученые довольно успешно их типологизировали: цитоскелет/ сигнальные - 64%; пузырьково-секреторный трафик - 18%; экстрацеллюлярные - 9%; полифункциональные - 9%. По абсолютным значениям 16 белков оказались серьезно вовлечены в процесс активации тромбогенеза (14 - сигнальные или белки цитоскелета, 9 - задействованы в активации aIIbb3 и/ или GPVI-рецеторов при тромбообразовании). Несколько белков только в посттрансляционных модификациях вовлекались в процесс активации кровяных пластинок при свертывании. SPARC-гликопротеин значительно убывали в группе с ОКС без ST по сравнению с контролем. В целом, тромбоциты от больных с ОКС без ST демонстрировали характеристический протеомный профайл, что является очень ценным для диагностики и дальнейшего изучения сердечно-сосудистых заболеваний.
Prentice RL, Paczesny S, Aragaki A, Amon LM et al. Novel proteins associated with risk for coronary heart disease or stroke among postmenopausal women identified by in-depth plasma proteome profiling. Genome Med. 2010 Jul 28; 2(7): 48.
В свежей работе Исследовательского Центра рака Фреда Хатчинсона (Сиэтл) уточнены свойства протеинов, ассоциированных с риском ИБС и инсультов в группе пожилых женщин, пребывающих в менопаузе. Дизайн: образцы плазмы взяты у всех участников рандомизированного исследования WHI (посвящено заместительной гормонотерапии в менопаузе) на этапе включения. Впоследствии данные об исходных плазменных протеомных профайлах сопоставлялись в 3 группах (800 женщин, у которых через год случился инсульт; 800 - у которых через год диагностированы признаки ИБС; контроль 1:1). Достоверная межгрупповая разница была отмечена по 37 протеинам для ИБС и по 47-ми - для инсультов. Кандидат на роль биомаркера риска ИБС у пожилых женщин с заместительной гормонотерапией - β-2-микроглобулин. Кандидат на роль биомаркера риска инсульта в той же когорте - IGFBP4 (4-я модификация связывающего протеина инсулино-подобного фактора роста).
Компания Адвенсум предлагает обширную линейку биохимических анализаторов и лабораторного оборудования для проведения самых сложных и глубоких диагностических тестов, а так же для осуществления научно изыскательских работ в фундаментальных и прикладных отраслях медицинской науки. Кроме того, Адвенсум обладает богатым опытом поставок новейшего инструментария и оборудования для кардиохирургии, интервенционного лечения сердечно-сосудистых заболеваний.

