Международный научно-клинический консенсус о «золотом стандарте» лечения атеросклеротических поражений сонных артерий состоялся около 20 лет назад, с завершением первых крупных рандомизированных клинических исследований (NASCET и др.) Тогда было сформировано положение о преимуществе хирургической каротидной эндартерэктомии над консервативными лечебными тактиками.
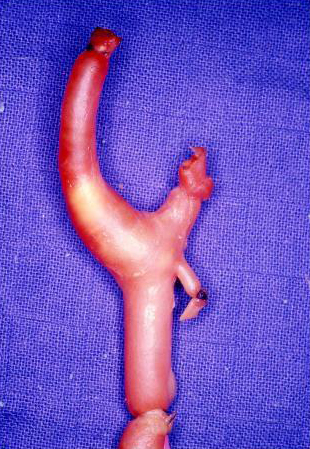
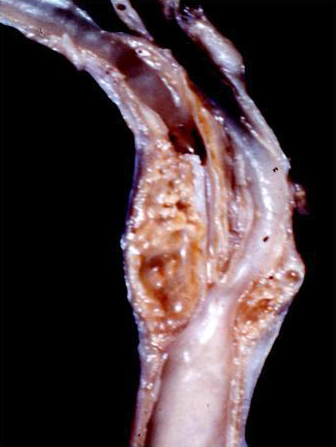
В 1999 году Mathias K et al. докладывали об опыте 799 ангиопластик у 633 больных (70% симптоматических и 30% асимптомных каротидных стенозов). Постоянный неврологический дефицит возникал в 2,7% случаев, был сделан вывод об эффективности каротидного стентирования, которое может применяться как у пациентов с показаниями к хирургическому варианту лечения, так и у больных с противопоказаниями к стандартной эндартерэктомии по техническим и медицинским причинам.
Уже через 5 лет Balzer K. (2004) проанализировал результаты крупных международных клинических исследований (ACAS, NASCET, ECST, ACST) и обозначил хирургическую тактику (эндартерэктомия) как наиболее приемлемую с точки зрения доказательности. Однако, то же самое сказать про стентирование сонных артерий, по мнению немецкого автора, нельзя. Дело не только в недостатке завершенных доказательных исследований (по состоянию на 2004 год). Точки зрения на связь между морфологией бляшки и риском эмболических осложнений на тот момент были слишком противоречивы. Приведены последовательные аргументы против дуплексного ультразвука как метода предоперационной оценки риска эмбологенности каротидной бляшки. Напротив, при транскраниальном допплере транзиторные эхосигналы высокой интенсивности (соответствующие отлетевшим от каротидных бляшек микроэмболам) при стентировании отмечаются существенно чаще, нежели при эндартерэктомии. В заключении Balzer K. сформулировал довольно жесткие положения о том, что эндартерэктомия остается «золотым стандартом», и, ввиду превосходства, не может сравниваться с каротидным стентированием по критериям эффективности и безопасности. Ангиографические техники можно применять только в контролируемых рандомизированных исследованиях для окончательного решения вопроса о судьбе метода. Публикация Balzer K. особенно ценна в связи с тем, что автор работает в одной из немецких клиник. А ведущие производители одноразового инструментария для каротидных ангиопластик в подавляющем своем большинстве не являются резидентами Германии. Таким образом, немецкий ученый выступил в качестве независимого эксперта, его статья вряд ли является проявлением информационного промышленного протекционизма и не обладает признаками «затравочной».
К 2008-му году появились 4-х летние результаты крупного рандомизированного мультицентрового сравнительного исследования по ангиопластике против эндартерэктомии при стенозах с тяжелой симптоматикой (EVA-3S). Вывод - безопасность стентирования необходимо улучшить перед тем, как рекомендовать данный метод в качестве альтернативы эндартерэктомии.
Naylor AR et al. (2009) через 5 лет после статьи Balzer K. по-прежнему констатировали недостаток доказательности вокруг методики каротидного стентирования (хотя за такой промежуток времени недвусмысленные клинические результаты рандомизированных trial-ов получить уже было бы можно). По-прежнему невнятны критерии отнесения пациента к категории «высокого риска инсульта». Между тем, в статье приведены миллиардные цифры ежегодных финансовых затрат на ненужные и необоснованные интервенции в системе здравоохранения США.
Наконец, во второй половине 2010-го года стали доступны для метаанализа результаты уже 4-х крупнейших сравнительных исследований дизайна «каротидное стентирование против эндартерэктомии» (EVA-3S, SPACE, ICSS и CREST). И, тем не менее, Van Damme H, Defraigne JO (2010) снова обнаружили отсутствие веских доказательств, которые бы обосновывали широкое повседневное использование ангиографической методики. Более того, авторы провели сводку большого количества научных сообщений по теме и выявили три закономерности:
А) Каротидное стентирование сопровождается превосходящим количеством перипроцедурных смертей от инсульта.
В) Рентгенхирургическая методика более затратна экономически.
С) Так же она сопровождается большим риском микроэмболизаций в процессе интервенции.

Рис. 1 - Детрит атеросклеротической бляшки сонной артерии, аспирированный при использовании антиэмболического протектора
Источник: Whitlow PL, Lylyk P, Londero H, Mendiz OA et al. Carotid artery stenting protected with an emboli containment system. Stroke. 2002 May; 33 (5): 1308-14.
По всей видимости, единственным крупным источником положительных аргументов в пользу каротидного стентирования является на сегодняшний день trial SAPPHIRE, однако выборка для ангиопластик сонных артерий с противоэмболиечской защитой состояла только из пациентов с ВЫСОКИМ РИСКОМ эндартерэктомии.
Таким образом, к концу 2010-х поначалу оптимистичное отношение к ангиографическим техникам лечения атеросклеротических поражений сонных артерий сменилось скепсисом и критикой, наметилось ужесточение формулировок по отношению к каротидному стентированию.
Так в чем же дело? Почему, несмотря на появление новых моделей стентов, разработку antijump-систем и новых конструкций защиты от эмболов результаты до сих пор спорные, и консенсус до сих пор не изменился - стентирование только у тех, кому противопоказана эндартерэктомия?
В крупнейшем отечественном Руководстве по рентгенэндоваскулярной хирургии сердца и сосудов под редакцией Л. А. Бокерия, и Б. Г. Алекяна (2008) приводится тезис о том, что противоэмболическая защита - в источнике детально описаны защиты баллонного типа, фильтры и устройства реверсивного кровотока - показана при всех каротидных стентированиях (соответствующий раздел Руководства составлен зарубежными авторами M. Henry, I. Henry, A. Polydorou, M. Hugel). Данный постулат подтвержден одной-единственной ссылкой на доклад Roubin GS, датируемый 2002-м годом (ссылка №39 на стр. 102 1-го тома Руководства).
Вместе с тем, есть свидетельства о сходной эффективности и безопасности ангиопластик сонных артерий вообще без противоэмболических защит. Все в том же Руководстве Л. А. Бокерия, и Б. Г. Алекяна (2008), в том же 1-м томе на той же 102-й странице в первом абзаце сверху написано: «Недавние исследования показали, что стентирование даже без защиты головного мозга может быть выполнено с приемлемым риском наступления в послеоперационном периоде инсульта/ смерти (2,9 - 8,2%)». И далее - подтверждение аж 10-ю ссылками (!) на статьи разных авторских коллективов.
Kastrup A et al. (2008) констатировали, что «рутинное использование дистальных фильтров при каротидной ангиопластике/ стентировании противоречиво». Это послужило основанием для исследования связи между установкой этих фильтров и частотой новых нарушений в головном мозге по данным диффузной МРТ (дМРТ). Группы сравнения - 68 пациентов с защитой и 175 без какой-либо инструментальной антиэмболической протекции. ДМРТ выполняли непосредственно перед интервенцией и сразу после. Так же учитывались возраст и симптоматический статус. И вот что получилось:
Соотношение пациентов с признаками новых поражений в головном мозге после интервенции по данным дМРТ (все р < 0,05)
| С каротидной защитой | Без каротидной защиты |
| 52% | 68% |
| Пациенты с симптомами | Асимптомные |
| 56% | 74% |
| Моложе 75 лет | Старше 75 лет |
| 46% | 67% |
При этом в группах ассимптоматических пациентов и у тех, кому больше 75 лет, пропорции больных с новыми поражениями и количеств новых патологических очагов в головном мозге после вмешательства незначительно отличались для категорий «с защитой»/ «без защиты». То есть при самой строгом инструментальном отражении методом дМРТ даже мельчайших клинически незначимых эмболизаций головного мозга выяснилось, что защита эффективна и принципиальна НЕ ВО ВСЕХ СЛУЧАЯХ и НЕ ДЛЯ ВСЕХ КОНТИНГЕНТОВ НАСЕЛЕНИЯ С ПОРАЖЕНИЯМИ СОННЫХ АРТЕРИЙ.
Maynar M et al. (2007) произвели проработку безупречной с точки зрения классической статистики выборки - 100 человек. Согласно основам биометрии достоверные различия на таком объеме особенно ценны, поскольку р менее 0,005 на сравнении больших (особенно многотысячных) групп, которые модны в современных многоцентровых клинических исследованиях, не всегда отражает важную, существенную межгрупповую разницу. Испанские клиницисты сознательно пошли по пути уменьшения количества манипуляций в ходе вмешательства, исходя из принципа «чем меньше инструментальной возни в супра-аортальном сосудистом древе, тем меньше риск смещения материала бляшек». Вообще же в преамбуле своей статьи Maynar M et al. акцентировали такие недостатки любых приспособлений каротидной защиты, как «дополнительные марипуляции, удорожание и увеличение риска процедуры». Кроме того, авторами упомянуты свидетельства о так называемой
«тихой церебральной ишемии» у 25% (!) больных при стентировании с устройствами профилактики эмболий.
Итак, в работе Maynar M et al. (2007) оценки неврологического статуса, УЗИ сонных артерий и рентгенограмм шеи производились через 1, 3, 6 и 12 месяцев после вмешательства. И вот что получилось. 98 успешных установок стента из 100, перипроцедурные осложнения - 1 легкий инсульт, 1 инвалидизирующий инсульт с выпадением функций, 5 транзиторных ишемических атак. В течение follow-up периода зафиксировано 5 смертей, не обусловленных патологическим процессом в каротидных артериях, не было ни одного инсульта. Заключение: в приведенном исследовании каротидное стентирование без каких-либо устройств противоэмболической защиты было эффективным, безопасным, с низкой частотой перипроцедурных осложнений в пределах допустимых по AHACCR цифр (инсульт вследствие ангиопластики должен быть не более 6% у пациентов с симптомами и не более 3% у асимптомных).
Собственно, критика различных типов каротидных антиэмболических девайсов-протекторов и описание связанных с ними осложнений занимает достойное место почти во всех современных руководствах по стентированию сонных артерий. Попытки проведения устройств через точки патологических сужений сами по себе могут надрывать бляшку и вызывать фонтан крупных частиц детрита, могут случаться диссекции здоровой интимы с последующим генезисом тромботических микроэмболов. Случаются проблемы при извлечении защитного устройства в конце операции через сильно извитые участки артерии, бывают потери эмболов на этом этапе. Справедливо отмечается, что применение фильтров может сопровождаться спазмами сосуда.
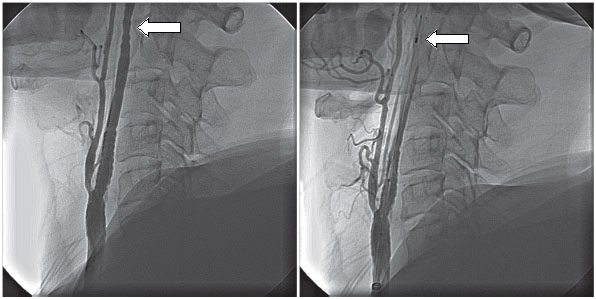 Рис. 2 - Каротидный ангиоспазм из-за использования фильтра-улавливателя эмболов (указан стрелочкой). Слева - мощный спазм после постдилятации. Справа - остаточный спазм внутренней сонной артерии после удаления устройства защиты из сосудистого русла. Источник: Vijayvergiya R, Otaal PS, Bagga S, Modi M. Symptomatic carotid vasospasm caused by a distal-protection device during stent angioplasty of the right internal carotid artery. Tex Heart Inst J. 2010; 37(2): 226-9.
Рис. 2 - Каротидный ангиоспазм из-за использования фильтра-улавливателя эмболов (указан стрелочкой). Слева - мощный спазм после постдилятации. Справа - остаточный спазм внутренней сонной артерии после удаления устройства защиты из сосудистого русла. Источник: Vijayvergiya R, Otaal PS, Bagga S, Modi M. Symptomatic carotid vasospasm caused by a distal-protection device during stent angioplasty of the right internal carotid artery. Tex Heart Inst J. 2010; 37(2): 226-9.
Свидетельства несовершенства существующих способов каротидной защиты при стентированиях столь весомы, что им посвящены крупные научные публикации. Например, Whitlow PL et al. (2002) при использовании антиэмболических протекторов баллонного типа в 5% случаев получали транзиторные неврологические нарушения. Piñero P et al. (2009), применявшие каротидные фильтры во время ангиопластик, наблюдали 3,5% неврологических осложнений, в том числе тяжелый инсульт. Они же провели подробный морфологический анализ фильтров после извлечения из сонной артерии. Был обнаружен интересный феномен - рыхлые конгломераты фибрина и тромбоцитов неплотно прилежат к наружным поверхностям пор фильтра, забивая их. По всей видимости, эти слепки способны отрываться от волокна сеточки протектора, далее лететь в церебральные сосуды и вызывать неврологические осложнения.
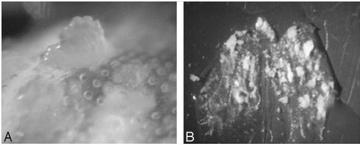
Рис. 3 - Фибрин и тромботические агрегаты на внешней (обращенной краниально) стороне фильтра-улавливателя.
А) Слепки фибрина и тромбоцитов, рыхло забившие поры на наружной поверхности каротидного фильтра.
В). Фильтр разрезан и вывернут, внутри его видны значительные массы крупных частиц. Источник: Pi?ero P, González A, Martínez E, Mayol A et al. Volume and composition of emboli in neuroprotected stenting of the carotid artery. AJNR Am J Neuroradiol. 2009 Mar; 30(3): 473-8.
Сравнивая эффективность и безопасность разных типов девайсов-протекторов для сонных артерий (баллонного и фильтрового), Kim SJ et al. (2007) использовали данные дМРТ головного мозга. В обеих группах частота перипроцедурных новых ишемических очагов составила около 39%, причем в 7-9% манифестировала клиника гемипарезов, атаксий, а так же инфарктов сетчатки. Примечательно, что дМРТ-признаки новых церебральных патологических очагов часто возникали в анатомических регионах, не связанных с бассейном «выключаемой» защитным устройством артерии (например, контралатерально).
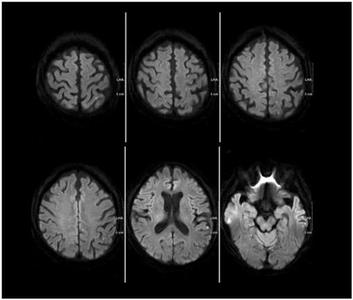
Рис. 4 - Множественные новые гиперинтенсивные очаги после стентирования с использованием ловушки-фильтра у мужчины 71 года. Неврологической симптоматики не зафиксировано. Источник: Kim SJ, Roh HG, Jeon P, Kim KH et al. Cerebral ischemia detected with diffusion-weighted MR imaging after protected carotid artery stenting: comparison of distal balloon and filter device. Korean J Radiol. 2007 Jul-Aug; 8(4): 276-85.
Таким образом, на сегодняшний день можно констатировать КРИЗИС МЕТОДИКИ КАРОТИДНОГО СТЕНТИРОВАНИЯ С ИСПОЛЬЗОВАНИЕМ ПРОТИВОЭМБОЛИЧЕСКОЙ ЗАЩИТЫ. Не привнося значимого уменьшения процента обусловленных вмешательством неврологических осложнений, устройства защиты сами являются причиной специфических патологических реакций. Не все эмболы, летящие в головной мозг из бляшки, задерживаются девайсами. Однако при этом происходит значительное уменьшение церебрального кровоснабжения (даже при установке фильтра), мозговой кровоток перекрывается на длительный промежуток времени - до 11-ти минут. Не до конца ясно - что же, все-таки, губительней для серого и белого вещества cerebrum? Микроэмболизация артериол и прекапилляров? Так на микроциркуляторном уровне коллатерально-сетевая архитектура сосудистого русла исключает длительное запустение капилляров дистальней сладжа. Или же выраженная, длительная гипоксия от перекрытия внутренней сонной девайсом-протектором? В особенности у лиц, которым в силу действующего отраслевого клинического консенсуса противопоказана эндартерэктомия. То есть у больных с тяжелыми хроническими, сопутствующими заболеваниями, генерализованным атеросклерозом и без того подорванным потенциалом адаптации к гипоксии, с нарушениями в контралатеральных сонных артериях и разобщенным велизиевым кругом и др. И еще - защитные каротидные девайсы неоправданно усложняют и удорожают процедуру, увеличивают облучение врача и больного.
По всей видимости, на текущем уровне развития науки наши знания об аксон-аксональных и метасимпатических взаимодействиях в системе кровоснабжения головного мозга не полны. Неизученные патологические сосудистые и сосудисто-глиальные рефлексы и реакции мозга на длительную гипоксию лежат в основе наблюдаемой при ангиопластике сонных артерий неврологичсекой симптоматики.
Выход из этого кризиса возможен по трем направлениям:
1) Глубокое изучение автономной нервной регуляции сосудов головного мозга, физиологических и патологических рефлексов, механизмов антигипоксической компенсации/ защиты нейронов и глиальных элементов.
2) Разработка новых фармпрепаратов - нейропротекторов; суперселективных ингибиторов нейронной передачи для рефлекторных дуг, задействующих крупные артерии; модуляторов коагуляции крови и тромбообразования в мелких сосудах головного мозга и др.
3) Технологическое совершенствование операции ангиографического стентирования сонных артерий с разработкой новых принципов доставки и антиэмболической защиты. Разработка новых устройств-протекторов, уменьшающих циркуляторную гипоксию перекрытия в несколько раз и обладающих упрощенной техникой быстрой доставки и установки, а так же гарантирующих более эффективное улавливание частиц детрита бляшки.
Признаками «концепта завтрашнего дня» в технологиях защиты от эмболов сонных артерий обладает устройство
TWIN ONE производства Minvasys (Франция). Принцип действия - перекрытие внутренней сонной артерии баллоном-окклюдером только на момент постдилятации, поскольку, согласно многочисленным клиническим свидетельствам, это самый «эмболоопасный» момент ангиопластики.
Основоположник методики церебральной противоэмболической защиты при каротидной ангиопластике,
J. Theron с соавторами, в 2009-м году доложил о своем опыте использования систем TWIN ONE в реальной клинической практике. Ими было выполнено 217 каротидных стентирований как у симптоматических, так и у асимптомных больных (209 пациентов, 8 из них перенесли двухстороннюю ангиопластику). Перипроцедурные осложнения - 1,8% (4 случая - 3 инсульта и одна транзиторная ишемическая атака) в течение 3-х часов после интервенции + 2 (0,92%) ишемических осложнения в течение госпитализации. Средняя продолжительность защитной окклюзии на постдилятации стента -
3,9 минут.
Таким образом, инновационная методика упрощенной противоэмболической защиты с помощью устройства TWIN ONE при ангиопластике сонных артерий имеет достаточную доказательную базу для своего применения, и может широко использоваться в российских клинических центрах. Возможно, это одна из тех технологий, благодаря которым стентирование сонных артерий обретет свое «второе дыхание».
Использованная литература:
1) Рентгеноэндоваскулярная диагностика и лечение: достигнутые рубежы и перспективы развития. Под ред. В. В. Демина. Оренбург, ИПК «Газпромпечать», ООО «Оргенбург-газпромсервис», 2010. - 608 с., с. 366 - 383.
2) Рентгеноэндоваскулярная хирургия заболеваний магистральных сосудов. Под. ред. Л. А. Бокерия, Б. Г. Алекяна, М. Анри. Том. 1. Москва, НЦССХ им. А. Н. Бакулева РАМН, 2008, 598 с., с. 101 - 148.
3) Balzer K. Treatment of carotid stenosis: carotid surgery or stent? In favor of operation. Herz. 2004 Feb; 29(1): 90-103.
4) Kastrup A, Gröschel K, Nägele T, Riecker A et al. Effects of age and symptom status on silent ischemic lesions after carotid stenting with and without the use of distal filter devices. AJNR Am J Neuroradiol. 2008 Mar; 29(3): 608-12.
5) Kim SJ, Roh HG, Jeon P, Kim KH et al. Cerebral ischemia detected with diffusion-weighted MR imaging after protected carotid artery stenting: comparison of distal balloon and filter device. Korean J Radiol. 2007 Jul-Aug; 8(4): 276-85.
6) Mas JL, Trinquart L, Leys D, Albucher JF et al. Endarterectomy versus Angioplasty in Patients with symptomatic severe carotid. Stenosis (EVA-3S) trial: results up to 4 years from a randomised, multicentre trial. Lancet Neurol. 2008 Oct; 7(10): 885-92.
7) Mathias K, J?ger H, Sahl H, Hennigs S, Gissler HM. Interventional treatment of arteriosclerotic carotid stenosis. Radiologe. 1999 Feb; 39 (2): 125-34.
8) Maynar M, Baldi S, Rostagno R, Zander T et al. Carotid stenting without use of balloon angioplasty and distal protection devices: preliminary experience in 100 cases. AJNR Am J Neuroradiol. 2007 Aug; 28(7): 1378-83.
9) Naylor AR, Gaines PA, Rothwell PM. Who benefits most from intervention for asymptomatic carotid stenosis: patients or professionals? Eur. J. Vasc. Endovasc. Surg. 2009 Jun; 37(6): 625-32.
10) Pi?ero P, Gonz?lez A, Mart?nez E, Mayol A et al. Volume and composition of emboli in neuroprotected stenting of the carotid artery. AJNR Am J Neuroradiol. 2009 Mar; 30(3): 473-8.
11) Theron J, Venturi C, Reul J, Milosevic Z et al. Immediate and 30-day clinical outcome of patients treated with the TwinOne cerebral protection system: multicenter experience in 217 cases. Cardiovasc. Intervent Radiol. 2009 Nov; 32(6): 1139-45.
12) Van Damme H, Defraigne JO. Do we need a new carotid artery stenting trial? Acta Chir Belg. 2010, Jul-Aug; 110 (4): 432-44.
13) Vijayvergiya R, Otaal PS, Bagga S, Modi M. Symptomatic carotid vasospasm caused by a distal-protection device during stent angioplasty of the right internal carotid artery. Tex Heart Inst J. 2010; 37(2): 226-9.
14) Whitlow PL, Lylyk P, Londero H, Mendiz OA et al. Carotid artery stenting protected with an emboli containment system. Stroke. 2002 May; 33(5): 1308-14.
 Рис. 2 - Каротидный ангиоспазм из-за использования фильтра-улавливателя эмболов (указан стрелочкой). Слева - мощный спазм после постдилятации. Справа - остаточный спазм внутренней сонной артерии после удаления устройства защиты из сосудистого русла. Источник: Vijayvergiya R, Otaal PS, Bagga S, Modi M. Symptomatic carotid vasospasm caused by a distal-protection device during stent angioplasty of the right internal carotid artery. Tex Heart Inst J. 2010; 37(2): 226-9.
Рис. 2 - Каротидный ангиоспазм из-за использования фильтра-улавливателя эмболов (указан стрелочкой). Слева - мощный спазм после постдилятации. Справа - остаточный спазм внутренней сонной артерии после удаления устройства защиты из сосудистого русла. Источник: Vijayvergiya R, Otaal PS, Bagga S, Modi M. Symptomatic carotid vasospasm caused by a distal-protection device during stent angioplasty of the right internal carotid artery. Tex Heart Inst J. 2010; 37(2): 226-9.